par Fred Gardner et le Dr John McPartland.
Nous ne pouvons qu’imaginer comment les gens, il y a d’innombrables milliers d’années, ont découvert qu’une certaine plante avait des propriétés curatives. Peut-être qu’une femme ramassait des graines pour se nourrir lorsqu’elle a eu des règles douloureuses. Alors qu’elle extrayait les graines des sommités fleuries de la plante, une résine collante a recouvert ses mains. Elle a rongé un peu de cette substance gommeuse. Peu après, elle a commencé à se sentir mieux.
Ses amis ont confirmé qu’il s’agissait bien d’une plante qui réduisait les crampes. Ils ont commencé à la cultiver volontairement. Lorsque leur tribu s’est déplacée, ils ont apporté des graines pour les mettre en terre dans leur prochaine colonie. Des découvertes similaires ont dû être faites de nombreuses fois dans de nombreux groupes. Les gens ont fini par comprendre que les graines étaient nourrissantes, que la résine soulageait la douleur et que la tige fournissait des fibres pour les cordes et les filets.
Ici et là, les tribus ont commencé à cultiver intentionnellement cette plante particulièrement utile. Les détails se perdent dans les brumes de l’histoire, mais la plante demeure et les botanistes la connaissent sous le nom de Cannabis. (Le nom latin de la plante est en italique, et le cannabis, le produit fabriqué à partir de la plante, ne l’est pas)
Lecannabis a évolué bien avant l’homme, mais comme personne n’a trouvé de macrofossiles de cannabis dans les roches, il est difficile de dire quand. Deux études sur l’ADN estiment que le cannabis a évolué il y a 21 ou 27,8 millions d’années. Le pollen fossile identifié comme étant du cannabis date d’il y a 787 000 ans dans le sud de la Sibérie.
Du pollen plus jeune, d’environ 125 000 ans, a été extrait d’une tourbière sibérienne. Des ossements néandertaliens datant de la même époque ont été trouvés dans une grotte à 30 kilomètres de là. Quelque temps après la migration de l’Homo sapiens dans la région il y a 40 000 ans, nous avons forgé un partenariat avec la plante.
« Le chanvre a suivi l’homme naturellement », a écrit Nicolaï Vavilov, le grand scientifique russe spécialiste des plantes, « en restant près de ses lieux d’habitation, en s’installant sur les déchets et partout où le sol a été cultivé. » L’image de « suiveur de camp » du chanvre a été popularisée par Edgar Anderson, un botaniste bien connu de l’université de Harvard et du jardin botanique du Missouri.
À un moment donné, les gens ont commencé à sélectionner les plantes présentant les caractéristiques qu’ils appréciaient pour les cultiver – de grandes tiges, de grosses graines huileuses ou une résine curative et psychoactive. Vavilov, Anderson, Carl Sauer, Andrew Sherratt et Carl Sagan ont établi un lien entre les origines de l’agriculture et les efforts de nos ancêtres pour cultiver un cannabis plus utile. Sauer a proposé que l’agriculture ait été développée par des personnes vivant dans des communautés de pêcheurs le long de rivières et de lacs (l’habitat de l' »herbe à fossés ») qui ont commencé à cultiver les plantes comme source de lignes et de filets de pêche. Personne ne sait exactement où et quand.

Culture du cannabis dans les montagnes du Rif, au Maroc
Classification
Le botaniste suédois Carl Linnaeus a décrit officiellement le Cannabis sativa en 1753. Trente-deux ans plus tard, Jean Baptiste Lamarck a identifié le Cannabis indica comme une deuxième espèce. Les experts continuent à débattre de la question de savoir s’il faut les classer comme des espèces distinctes ou comme des variétés distinctes d’une même espèce. Les populations existantes d’une éventuelle troisième espèce, Cannabis ruderalis, pourraient être une relique de type sauvage descendant de l’ancêtre de C. sativa.
Puis vint le That ’70s Show, lorsque la taxonomie du cannabis se retrouva mêlée au système juridique américain. L’ethnobotaniste Richard Evans Schultes, témoin de la défense, a affirmé que les lois sur les stupéfiants se référaient à C. sativa, alors que l’accusé possédait C. indica, qui était statutairement négligé et techniquement légal. Ernest Small, un botaniste taxonomiste, a plaidé en faveur d’une seule espèce au nom des plaignants.
Malheureusement, Schultes et son collègue Loren Anderson ont opéré des changements subtils dans la taxonomie du cannabis, s’éloignant ainsi des concepts originaux de Linné et de Lamarck. Ils ont inclus des plantes à drogues ainsi que des plantes à fibres dans C. sativa. (Nous savons aujourd’hui que les plantes à drogues sont riches en 9-tétrahydrocannabinol ou THC, et que les plantes à fibres sont riches en cannabidiol ou CBD) Les spécimens de C. sativa de Linné ont été examinés par William Stern en 1974 et il s’est avéré qu’il s’agissait d’un « ancien stock de chanvre cultivé du nord de l’Europe » – des plantes à dominance CBD, pas de la dope.

Le défenseur de l’environnement et militant du chanvre David Bronner, président de Dr. Bronner’s Magic Soaps, inspecte un champ de chanvre industriel dans le Colorado, en 2013. Voir www.drbronner.com pour plus d’informations.
Schultes et Anderson ont délimité C. indica aux plantes que Schultes a vues en Afghanistan. Ils ont ainsi caractérisé « indica » comme des plantes courtes, densément ramifiées avec des folioles larges, et « sativa » sur le modèle des espèces de Lamarck – hautes, faiblement ramifiées, avec des folioles étroites. Ils ont donné naissance à la taxonomie vernaculaire de « sativa » et « indica » qui est encore utilisée aujourd’hui. Avec l’intérêt croissant pour les plantes à forte teneur en DBC, dont certaines sont des C. sativa au sens linnéen, la taxonomie vernaculaire est devenue vraiment confuse.
Le botaniste Karl Hillig distingue ces populations : C. sativa représente les plantes à dominante CBD d’Europe, soit cultivées( biotypeC. sativa hemp), soit de type sauvage( biotypeC. sativa feral).
C. indica représente les plantes à dominante THC d’Asie, soit les plantes de Lamarck d’Inde – C.indica NLD (« diamètre étroit des folioles », connu sous le nom de « sativa » dans la langue vernaculaire) ou les plantes d’Afghanistan – C. indica WLD (« diamètre des folioles sauvages », l ‘ »indica » dans la langue vernaculaire ).
Les naturalistes Robert Clarke et Mark Merlin ont adopté le système de Hillig et l’ont élargi. En examinant la répartition mondiale des plantes de cannabis – sauvages, cultivées et férales (une fois cultivées, à nouveau sauvages) – ces experts concluent que :
Le chanvre à feuilles étroites, C. sativa, sous-espèce sativa, a été cultivé principalement en Europe.
Le chanvre à feuilles larges, C. indica, sous-espèce chinensis, était cultivé en Chine, en Corée, au Japon et en Asie du Sud-Est.
Les plantes médicinales à feuilles étroites, C. indica, sous-espèce indica, étaient cultivées en Asie du Sud et du Sud-Est et au Moyen-Orient.
Les plantes médicinales à feuilles larges, C. indica, sous-espèce afghanica, étaient cultivées dans le nord de l’Afghanistan et au Pakistan.
Il convient de noter que le croisement et l’hybridation généralisés des plantes à feuilles étroites et à feuilles larges ont rendu l’application de ces termes botaniquement imprécise dans de nombreux cas.
Utilisation médicale avant l’ère moderne
Tous les célèbres berceaux de civilisation de l’Ancien Monde ont utilisé le cannabis à des fins médicales : la Chine, la Mésopotamie, la Grèce, l’Inde et peut-être l’Égypte. Les Scythes, une tribu de migrants qui inhalaient de la vapeur infusée de cannabis à des fins rituelles, ont quitté leur patrie sibérienne vers 800 avant Jésus-Christ. Ils n’avaient pas de langue écrite, mais leur mot pour désigner le cannabis a été reconstitué comme kanab, kanap, konaba ou kannabis. Les Scythes ont influencé les civilisations de la Chine, de l’Inde et de la Mésopotamie à l’aube de l’histoire.
Le médecin et historien Ethan Russo a visité une tombe dans le cimetière de Yánghai qui contenait près d’un kilo de cannabis. Il était grossièrement manucuré – des sommités fleuries, des feuilles et des graines, et pas de tiges. La tombe ne contenait pas de fibres de chanvre. Elle date de 766-416 avant notre ère. Des Scythes sont enterrés à proximité. Yánghai se trouve dans le bassin de Turpan, qui fait maintenant partie de la Chine.
Les anciens Chinois connaissaient le cannabis sous le nom de « má » Leur pictogramme pour má représente deux plantes suspendues à l’envers pour sécher. La combinaison de má avec le caractère yào (drogue) signifie « narcotique » ou « anesthésique »
Le légendaire médecin Shénnóng parle abondamment du má dans son texte médical à saveur taoïste, Shénnóng Ben Cao Jing (également connu sous le nom de Pen Ts’ao Ching). Il met en garde : « En consommer beaucoup peut permettre de voir des fantômes et de courir frénétiquement. Une prise prolongée peut permettre de communiquer avec l’esprit et rendre le corps léger. » Shénnóng aurait vécu il y a environ 4 000 ans, mais son existence légendaire n’a été mentionnée que vers 130 avant notre ère.
Les Scythes sont entrés dans l’histoire lorsqu’ils ont envahi la Mésopotamie sous le règne du roi Sargon II (722 705 avant notre ère). Après l’invasion de l’Assyrie par les Scythes, un nouveau mot est apparu dans le cunéiforme néo-assyrien. Ce mot, qui signifie « chanvre », se traduit par qunubu ou qunnabu. Le mot apparaît dans des contextes qui suggèrent qu’il était utilisé par les chamans, ce qui renforce le lien avec les Scythes.

Le pictogramme chinois « má » représente le cannabis – deux plantes suspendues à l’envers pour sécher.

La divinité hindoue Shiva est depuis longtemps associée au cannabis.
Hérodote, le « père de l’histoire » grec, a écrit de nombreux articles sur les Scythes vers 440 avant notre ère. Hérodote invente le mot xávvaßiç à partir d’un mot qu’il a adopté chez les Scythes. Il les a décrits utilisant le xávvaßiç comme cordage et tissu, et vaporisant le xávvaßiç dans de petites tentes.
En Inde, il existe plus de 50 mots pour désigner le cannabis et les produits dérivés. Des archéologues travaillant dans le bassin du Gange ont mis au jour des graines de cannabis datant d’au moins 1300 ans avant notre ère. L’Atharvaveda, compilé vers 900 avant notre ère, donne le nom de bhånga à une plante dont de nombreux experts pensent qu’il s’agit du cannabis. Ces dates précèdent l’arrivée des Scythes, dont la présence la plus ancienne dans l’Hindou Kouch pourrait remonter au 7e siècle avant notre ère.
Siddhartha Gautama (vers 563-483 avant notre ère), le Bouddha de notre ère historique, était un Indo-Scythien. Il aurait subsisté avec une graine de chanvre par jour pendant ses six étapes d’ascèse. Les praticiens de la médecine ayurvédique, le système traditionnel indien, recommandent cette plante pour lutter contre la douleur, l’insomnie et la perte d’appétit.
Le hiéroglyphe égyptien šmšmt a été interprété comme étant le cannabis. Le mot apparaît dans les textes des pyramides de 2350 avant notre ère, « les cordes (ou cordons) de la plante šmšmt » Cependant, c’est le lin et non le chanvre qui était la principale culture de fibres de l’Égypte ancienne. D’autres auteurs interprètent šmšmt comme Corchorus olitorius, une herbe fibreuse dont les feuilles sont consommées et utilisées médicalement en Égypte. Le mot ressemble également à šmšm, le mot arabe pour sésame. Les preuves de la présence du cannabis en Égypte remontent à l’époque romaine.
La célèbre anthropologue polonaise Sara Benet (neé Benetowa) affirme que kaneh bosm (qaneh bosem) est le cannabis dans l’Ancien Testament, Exode 30:22-25. Le mot est généralement traduit par « canne aromatique » Moïse a utilisé le kaneh bosm pour une huile d’onction sacrée. Benetowa note « l’étonnante ressemblance » entre le sémitique kanbos et le mot scythe pour Cannabis. Mais le Livre de l’Exode a été composé vers le 8e ou le 9e siècle avant notre ère, et les Scythes n’ont pas envahi la terre d’Israël avant 630 avant notre ère. À cette époque, les Israélites avaient déjà été dispersés et exilés par les Assyriens.
Lecannabis n’est pas originaire du Croissant fertile. Kanbos, également translittéré kanbus ou qannabbôs, apparaît pour la première fois dans la Mishnah, rédigée au 1er siècle avant notre ère.
Étant donné les preuves que les produits à base de cannabis étaient largement utilisés pour traiter les maladies dans le monde antique, le vrai mystère est de savoir pourquoi il est tombé en disgrâce – un phénomène historique qu’Ethan Russo a surnommé « Cannabis interruptus » Cherchant une explication, Russo a cité « la nature périssable » des archives historiques et « la propension de l’humanité à la guerre, aux invasions et aux conflits culturels constants »
C’est comme si les prohibitionnistes avaient toujours existé dans toutes les sociétés et que, de temps en temps, ils l’emportaient sur les médecins et les patients qui ont fait bon usage des produits du cannabis. Une théorie veut que dans de nombreuses cultures, les membres de la classe sacerdotale considéraient les plantes psychoactives comme une menace pour leur rôle d’intermédiaire entre le monde matériel et le monde spirituel. Ils ne voulaient pas que les gens aient des visions et des idées créatives sans leur supervision. À l’époque moderne, la prohibition du cannabis a constitué une méthode efficace de contrôle social – un mécanisme de financement et d’armement de la police et un marqueur de désobéissance parmi les citoyens.
Le schéma selon lequel le cannabis s’avère médicalement utile mais est interdit s’est poursuivi dans diverses parties du monde tout au long du Moyen-Âge. Dans l’Égypte islamique, selon Russo, « alors que beaucoup se moquaient de ses effets psychoactifs sur la base de l’interdiction des substances intoxicantes dans la charia musulmane, on reconnaissait souvent à contrecœur ses nombreux attributs médicaux »
Un roi égyptien a imposé une interdiction au 13e siècle, mais lorsque Napoléon a envahi l’Égypte en 1798, l’utilisation de la plante était largement répandue et les Français ont jugé bon d’imposer leur propre interdiction. Trente ans plus tard, un médecin français, Aubert-Roche, rapporte que lors d’une épidémie de peste à Alexandrie, le cannabis soulage la fièvre, l’agitation, la douleur, la bronchite et l’insomnie. Et c’est ainsi que le pendule a continué à osciller entre la proscription et la prescription.
Le cannabis dans la littérature médicale
L’Angleterre, comme la France, découvre le cannabis médical par l’intermédiaire de ses colonies. La nouvelle a été transmise par un brillant médecin né en Irlande et formé à Édimbourg, William Brooke O’Shaughnessy. La Compagnie britannique des Indes orientales a envoyé O’Shaughnessy à Calcutta dans les années 1830. C’est une jeune star, qui a déjà été récompensée pour avoir conçu un traitement efficace contre le choléra – la thérapie de remplacement des électrolytes – qui allait donner naissance à l’administration de médicaments par voie intraveineuse.
En Inde, O’Shaughnessy a observé que les médecins utilisaient des extraits de « gunjah » pour traiter un large éventail de problèmes médicaux, dont certains pour lesquels la médecine occidentale ne disposait d’aucun traitement utile. Il a étudié la littérature pertinente, mené des études sur les animaux et testé les effets du cannabis sur lui-même avant de traiter des patients. En 1839, O’Shaughnessy présente ses découvertes dans un article publié dans lesTransactions de la Société médicale et physique du Bengale : « Sur les préparations du chanvre indien, ou Gunjah (Cannabis Indica). »

Le Dr Tod Mikuriya tient le premier numéro de O’Shaughnessy’s, qu’il a cofondé avec Fred Gardner.

‘Sensi Star’ est une variété de Cannabis afghanica à forte teneur en THC.
Dans un hôpital de Calcutta, O’Shaughnessy traite des patients souffrant de rhumatismes, d’hydrophobie, de choléra, de tétanos et d’épilepsie « dans lesquels une préparation de chanvre a été employée avec des résultats qui me semblent justifier que nous anticipions une utilisation plus étendue et impartiale de cette préparation, qui apporterait un plus non négligeable aux ressources du médecin. »
La préparation de cannabis d’O’Shaughnessy – un extrait d’alcool – a soulagé les symptômes des trois patients atteints de rhumatismes dans son essai clinique. Le cannabis a sauvé la vie des patients atteints de tétanos (bien que l’un d’entre eux soit mort de la gangrène) et a épargné aux patients atteints d’hydrophobie les terribles agonies associées à la rage. Il a réduit la diarrhée chez le patient atteint de choléra. Quant à la petite fille vue à 40 jours avec des « convulsions infantiles », O’Shaughnessy rapporte que « l’enfant jouit maintenant d’une santé robuste et a retrouvé son aspect naturel, rond et joyeux » O’Shaughnessy pensait que le chanvre indien était le plus prometteur en tant qu’anticonvulsif.
En 1841, O’Shaughnessy retourne en Grande-Bretagne avec son message et, ce qui est tout aussi important, des graines de C. indica du type à feuilles étroites. Les plantes du type chanvre à feuilles étroites avaient été largement cultivées pour la fibre en Grande-Bretagne, mais le type drogue à feuilles étroites n’était jusqu’alors pas disponible. Son arrivée et la publication en 1843 des découvertes et des recettes d’O’Shaughnessy dans le Provincial Medical Journal ont permis aux chimistes de produire de puissantes teintures à utiliser selon les besoins des médecins et des patients. La médecine occidentale en était venue à employer le cannabis.
« L’utilisation des dérivés du cannabis à des fins médicinales s’est rapidement répandue dans la médecine occidentale », écrit Tod Mikuriya, MD, qui a rassemblé et republié les premiers articles de journaux dans Marijuana : Medical Papers 1839-1972. Des médecins prestigieux ont noté ses bienfaits, notamment William Osler, de l’université Johns Hopkins, qui a prescrit le cannabis comme traitement de première intention pour les migraines.
De retour en Inde, le gouvernement britannique a entrepris des études à grande échelle pour enquêter sur les « effets délétères supposés être produits par l’abus de ganja. » En 1894, unrapport exhaustif de la Commission indienne sur les médicaments à base de chanvre conclut : « L’opinion générale semble être que les effets néfastes de la ganja ont été exagérés »
Les prescriptions de médicaments à base de cannabis ont connu un pic entre 1890 et 1920 aux États-Unis. Parmi les facteurs de la baisse de la part de marché, on peut citer la concurrence de nouveaux médicaments synthétiques bon marché tels que l’aspirine, les opiacés injectables et les barbituriques, ainsi qu’un dédain croissant pour les herbes « brutes ».
Par-dessus tout, il y avait le problème de l’irrégularité de la puissance. Comme l’explique le U.S. Dispensatory de 1926, « en raison de la grande variabilité de la puissance des différents échantillons de cannabis, il est pratiquement impossible de déterminer approximativement la dose appropriée d’un échantillon individuel, si ce n’est par un essai clinique ». En raison des symptômes désagréables occasionnels provoqués par des préparations exceptionnellement puissantes, les médecins ont généralement fait preuve d’une prudence excessive dans les quantités administrées. » En d’autres termes, la puissance incohérente a entraîné la crainte d’un surdosage, ce qui a conduit à des préparations de cannabis trop faibles ! Cela explique pourquoi les consommateurs américains n’ont pas protesté lorsque le gouvernement fédéral a interdit la « marihuana » en 1937.

Pilules de cannabis enrobées de gélatine produites par McKesson & Robbins, l’une des nombreuses sociétés pharmaceutiques américaines qui commercialisaient des extraits de cannabis avant la prohibition de 1937

Reefer Madness est le nom d’un film qui a incarné la campagne de propagande qui a conduit à la prohibition fédérale de la marijuana en 1937.
Le seul témoignage contre la prohibition lorsque le Congrès en a débattu est venu de William Woodward, MD, de l’American Medical Association. Woodward a soutenu que « l’usage médical du cannabis, comme on vous l’a dit, a énormément diminué. Il est très rarement utilisé […] en partie à cause de l’incertitude des effets de la drogue. Cette incertitude a jusqu’à présent été attribuée à des variations dans la puissance des préparations provenant de plantes particulières utilisées…. Dire, cependant, comme cela a été proposé ici, que l’utilisation de la drogue devrait être empêchée par une taxe prohibitive, c’est perdre de vue le fait que des recherches futures pourraient montrer qu’il existe des utilisations médicales substantielles. » Quelle prescience !

Les pharmacologues Raphael Mechoulam (à gauche) et Yechiel Gaoni ont élaboré la structure moléculaire exacte du THC et du CBD et ont fait part de leurs découvertes en 1963 et 1964.
En 1938, le maire de New York, Fiorello LaGuardia, a chargé l’Académie de médecine de New York d’enquêter sur les allégations sur lesquelles reposait l’interdiction fédérale de la marijuana. Une commission de scientifiques et de médecins a conclu que la marijuana ne créait pas de dépendance et n’entraînait pas de folie ni de crimes violents. Les copies du « Rapport de la Commission LaGuardia » ont été achetées et détruites par les agents du Bureau fédéral des stupéfiants.
La fin de la Seconde Guerre mondiale a été suivie par près de deux décennies de diabolisation de la marijuana et des personnes qui la consommaient. Mais au début des années 1960, l’évolution de la science et de la société a provoqué des fissures dans le mur de la prohibition. Les structures moléculaires précises du THC et du CBD ont été déterminées en 1964 par les scientifiques israéliens Raphael Mechoulam et Y. Gaoni. Cette année-là, à New York, Bob Dylan partageait de la marijuana avec les Beatles, présageant une époque où des millions de jeunes gens dans le monde – en particulier des soldats et des étudiants – commenceraient à fumer de la marijuana, à évaluer ses effets par eux-mêmes et à remettre en question les affirmations du gouvernement.

Le Dr Mechoulam a popularisé le terme « effet d’entourage » pour décrire la façon dont les composés du cannabis agissent en synergie.
Preuves anecdotiques
Ceux qui ont commencé à fumer de la marijuana dans un cadre social dans les années 1960, 1970 et 1980 ne savaient généralement pas qu’elle avait été largement prescrite comme médicament dans un passé pas si lointain. Comme l’a dit le Dr Mikuriya, « ce n’est pas seulement la marijuana qui a été interdite, c’est la vérité sur l’histoire »
Des rapports anecdotiques sur l’efficacité médicale ont circulé. Il semble que tout le monde connaissait quelqu’un à l’hôpital VA qui utilisait de la marijuana contre la spasticité, ou une tante qui avait survécu à la chimio grâce à l’herbe, ou un ami qui disait que cela l’aidait à dormir. Mais aucun médecin ou chercheur ne suivait les patients qui consommaient de la marijuana.
En 1990, en réponse à l’épidémie de sida, un vétéran du Vietnam nommé Dennis Peron a créé le San Francisco Cannabis Buyers Club. Le club offrait un cadre dans lequel les personnes qui consommaient de la marijuana à des fins médicales pouvaient comparer leurs notes et se faire une idée de leur nombre. Mikuriya, voyant « une occasion unique de recherche », s’est engagé comme coordinateur médical et a commencé à interroger les membres sur leur état de santé, leurs habitudes de consommation de marijuana et leurs résultats.
Le remarquable club de Peron est devenu le quartier général des activistes qui travaillent à la légalisation de la marijuana à des fins médicales. Ils ont rédigé la « Proposition 215 », une mesure électorale qui permettrait aux patients ayant l’approbation d’un médecin d’utiliser le cannabis à des fins médicales. Les électeurs californiens ont adopté la proposition 215 en novembre 1996 par 56 voix contre 44, malgré l’opposition des forces de l’ordre et de tous les élus de l’État, à l’exception de Terence Hallinan, procureur de San Francisco.

Dennis Peron devant le San Francisco Cannabis Buyers Club au 1444 Market Street. En 1995, le club est devenu le quartier général des activistes qui préparaient l’initiative californienne sur la marijuana médicale.

Les fonctionnaires de l’administration Clinton, dirigés par le tsar des drogues Barry McCaffrey, ont dénoncé Tod Mikuriya, MD, et menacé les médecins qui ont approuvé l’utilisation de la marijuana par leurs patients après que les électeurs californiens ont adopté la Proposition 215 en novembre 1996.
À l’instigation du Dr Mikuriya, la nouvelle loi avait été rédigée de manière à couvrir non seulement les patients souffrant de quelques affections graves, mais aussi ceux souffrant de « toute autre affection pour laquelle la marijuana apporte un soulagement. »
En décembre 1996, le tsar des drogues américain Barry McCaffrey et le procureur général Janet Reno ont menacé de révoquer les licences de prescription des médecins californiens qui osaient approuver l’utilisation de la marijuana par les patients. Lors d’une conférence de presse largement médiatisée, McCaffrey a montré d’un air moqueur un grand tableau intitulé « Dr Tod Mikuriya’s (215 Medical Advisor) Medical Uses of Marijuana » (Utilisations médicales de la marijuana par le Dr Tod Mikuriya (215 Medical Advisor)) McCaffrey a déclaré qu’il était manifestement absurde qu’un seul médicament puisse être efficace pour traiter autant de maladies. « Ce n’est pas de la médecine », s’est-il moqué, « c’est un spectacle de Cheech et Chong »
L’Union américaine pour les libertés civiles et le groupe de réforme aujourd’hui connu sous le nom de Drug Policy Alliance ont soutenu un procès intenté par le spécialiste du sida Marcus Conant, MD, pour empêcher le gouvernement de mettre sa menace à exécution. Les tribunaux fédéraux ont donné raison aux plaignants en affirmant que les médecins et les patients ont le droit constitutionnel, en vertu du premier amendement, de discuter de la marijuana en tant qu’option de traitement.

Cheech et Chong sont devenus des icônes de la contre-culture du cannabis. Leurs films et leurs routines comiques ont tourné en dérision les dangers supposés associés à la marijuana.
Le système endocannabinoïde
Alors que le conflit politico-juridique prenait de l’ampleur, des scientifiques étudiant les effets du cannabis ont donné raison à Mikuriya. En 1990, alors que le Cannabis Buyers Club se forme à San Francisco, un groupe de scientifiques se réunit en Crète et crée la Société internationale de recherche sur le cannabis. Le « mot C » du nom du groupe sera remplacé par « cannabinoïde » en 1998 car, comme l’a expliqué un chercheur, « le domaine s’éloigne de la plante »
Les membres de l’ICRS étaient pour la plupart des pharmacologues et des biochimistes employés dans des centres de recherche universitaires. Presque tous recevaient ou convoitaient des fonds de l’Institut national américain sur l’abus des drogues (NIDA), une agence dont l’objectif déclaré depuis des années est de prouver la nocivité de la marijuana. Le Graal des scientifiques était un médicament qui exerce les effets bénéfiques du cannabis sans provoquer de psychoactivité.
Dans leur quête d’un tel médicament, les chercheurs ont découvert le système de signalisation endocannabinoïde du corps – des composés fabriqués dans le corps qui activent les récepteurs endogènes qui répondent également aux cannabinoïdes végétaux.
Les cannabinoïdes prédominants dans les plantes de cannabis sont le CBD et le THC. Le CBD, qui n’est pas psychoactif, prédomine dans les plantes de chanvre cultivées pour leurs fibres et/ou leurs graines. Le CBD a été identifié au début des années 1940 par Roger Adams, un chimiste de l’Université de l’Illinois, mais il n’a pas élaboré sa structure moléculaire précise.
Après la découverte des endocannabinoïdes, le CBD et le THC ont été rebaptisés « phytocannabinoïdes » – des composés présents dans la plante, presque tous constitués de 21 atomes de carbone dans des structures en anneau et des chaînes latérales, avec des atomes d’hydrogène et d’oxygène attachés à différents endroits.
Une centaine de phytocannabinoïdes ont été identifiés à ce jour, dont certains sont biologiquement actifs et pourraient avoir un potentiel médical. (Certains cannabinoïdes sont créés de façon fugace lors de l’analyse du matériel végétal, d’autres sont créés par les enzymes qui métabolisent les composés végétaux)
En plus des phytocannabinoïdes, la plante de cannabis biosynthétise des centaines de substances chimiques qui ne lui sont pas propres, dont certaines sont biologiquement actives, notamment les terpènes et les flavonoïdes qui donnent l’odeur, le goût et la couleur. Trois flavonoïdes uniques au cannabis ont été découverts : la cannflavine-A, -B et -C.
Les cannabinoïdes endogènes (« endo-« ) sont fabriqués dans notre corps pour envoyer des signaux d’une cellule nerveuse à une autre. Ces composés présents chez les animaux ont précédé les cannabinoïdes végétaux dans l’ordre d’apparition de l’évolution
évolution. Les endocannabinoïdes et les phytocannabinoïdes exercent des effets similaires lorsqu’ils sont testés sur des animaux de laboratoire : réduction de la douleur, de la température corporelle, de l’activité spontanée et du contrôle moteur.
Les composés synthétiques qui exercent ces effets sont également classés parmi les cannabinoïdes. En 1974, Eli Lilly a produit du nabilone, une forme synthétique de THC qui a été commercialisée sous le nom de Cesamet (et réintroduite des années plus tard sous le nom de Nabilone). Au milieu des années 1980, Pfizer a produit un composé synthétique, le CP-55940, qui s’est avéré trop psychoactif pour être commercialisé en tant que médicament. Mais contrairement au THC, qui n’est pas soluble dans l’eau et exerce un effet faible et fugace, le CP-55940 peut être manipulé en solution aqueuse et se lie suffisamment longtemps pour révéler l’endroit du corps où il agit. Cela a été une grande aubaine pour la recherche.
L’existence de récepteurs cannabinoïdes dans le cerveau a été établie en 1988 par William Devane qui travaillait dans le laboratoire d’Alynn Howlett à l’université de Saint-Louis. Les récepteurs sont des protéines intégrées dans les membranes cellulaires. Les endocannabinoïdes ou phytocannabinoïdes qui se lient à eux induisent une cascade d’événements moléculaires au sein des cellules.
Ces récepteurs, appelés plus tard récepteurs CB1, sont concentrés dans le cervelet et les ganglions de la base (régions responsables du contrôle de la motricité, ce qui pourrait expliquer pourquoi la marijuana soulagerait la spasticité musculaire), dans l’hippocampe (stockage de la mémoire à court terme) et dans le système limbique (contrôle des émotions). Les cannabinoïdes agissant par l’intermédiaire des récepteurs CB1 jouent un rôle dans les processus de récompense, de cognition et de perception de la douleur, ainsi que dans le contrôle de la motricité.

‘Sour Tsunami’, cultivée par Lawrence Ringo dans le comté de Humboldt, est une variété à dominante CBD. Ringo a mis les graines stabilisées à la disposition des utilisateurs médicaux.
En 1992, un deuxième récepteur de cannabinoïdes a été découvert dans les cellules de la rate, les globules blancs et d’autres zones « périphériques » du corps. La découverte du récepteur CB2 a ravivé l’espoir de développer des médicaments non psychoactifs efficaces impliquant le système immunitaire – et non le cerveau ou le système nerveux central.
Toujours en 1992, Devane et Lumir Hanas, travaillant dans le laboratoire de Mechoulam à l’Université hébraïque de Jérusalem, identifient le premier cannabinoïde endogène, une molécule relativement simple appelée N arachidonylethanolamine (AEA). L’anandamide agit sur les récepteurs CB1 et CB2. Ses effets sont reproduits par le THC. Toujours dans le laboratoire de Mechoulam, Shimon Ben-Shabat a découvert en 1994 un deuxième cannabinoïde endogène, le 2-AG (2 arachidonoylglycérol), qui se lie également aux récepteurs CB1 et CB2. Contrairement à l’anandamide, qui est un agoniste relativement faible, le 2-AG est généralement un agoniste complet du récepteur CB1.
L’anandamide et le 2-AG sont des neuromodulateurs inhabituels en ce sens qu’ils agissent par un processus appelé « signalisation rétrograde » Les neurotransmetteurs classiques – sérotonine, dopamine, etc. – traversent l’espace (synapse) entre une cellule émettrice « présynapique » et une cellule réceptrice « postsynapique ». Les endocannabinoïdes sont fabriqués à la demande dans le neurone postsynaptique et renvoyés à travers la synapse pour indiquer à la cellule émettrice de baisser le ton ou d’accélérer.
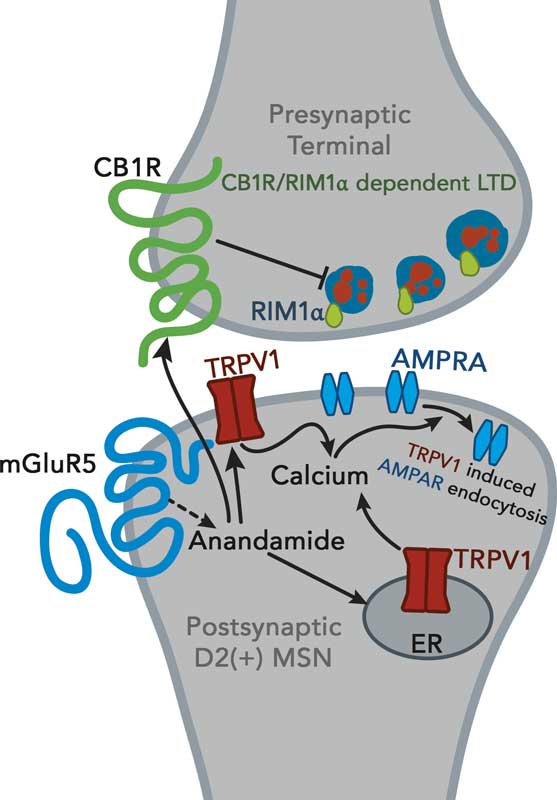
Une cellule nerveuse envoie des signaux chimiques à travers un espace – la synapse – pour activer une cellule réceptrice. Les endocannabinoïdes sont fabriqués à partir de la membrane de la cellule réceptrice et renvoyés à travers la synapse pour ajuster la vitesse de transmission.
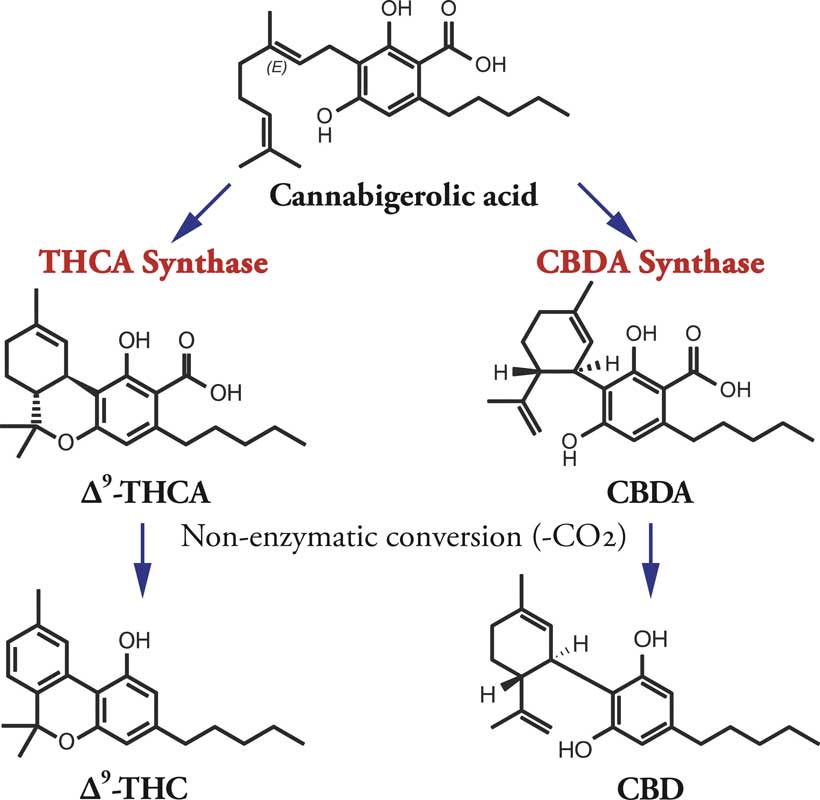
Les cannabinoïdes végétaux ont 21 molécules de carbone avec de l’oxygène et de l’hydrogène attachés à différents endroits.
L’anandamide et le 2-AG rétablissent l’équilibre – l’homéostasie – en inhibant les cellules nerveuses qui tirent trop intensément et en désinhibant les cellules nerveuses qui tirent trop lentement. Pense à un chef d’orchestre qui fait face à un orchestre et qui dirige le tempo et le volume auxquels les instruments produisent leurs sons. Le système endocannabinoïde est le
maître du ton dans le corps.
Les endocannabinoïdes envoient leurs signaux de maintien de l’équilibre dans les systèmes qui régulent l’appétit, le mouvement, l’apprentissage (et l’oubli), la perception de la douleur, la réponse immunitaire et l’inflammation, la neuroprotection et d’autres processus vitaux.
Le fait que la signalisation endocannabinoïde fasse partie intégrante de chaque processus physiologique explique pourquoi la prise de cannabinoïdes – l’inhalation de vapeur de cannabis, par exemple – peut être bénéfique aux patients souffrant de n’importe lequel des symptômes et conditions médicales figurant sur la tristement célèbre liste de Tod Mikuriya. Les scientifiques ont expliqué ce qu’il a observé et rapporté !
Lors de la réunion de 2013 de l’Association internationale pour les médicaments à base de cannabinoïdes, Raphael Mechoulam a cité avec approbation un article qui concluait que « la modulation de l’activité endocannabinoïde peut avoir un potentiel thérapeutique dans presque toutes les maladies affectant les humains. »
Lors de chaque réunion annuelle de la Société internationale de recherche sur les cannabinoïdes, l’accent a été mis davantage sur les applications thérapeutiques et moins sur la responsabilité de l’abus de médicaments. Les études soumises pour présentation lors de la réunion de 2014 reflétaient un regain d’intérêt pour la plante de cannabis elle-même.
Ce que les médecins ont appris
L’initiative californienne de 1996 sur la marijuana médicale n’a pas créé de système d’enregistrement, car Dennis Peron et ses coauteurs ne voulaient pas générer une liste principale de consommateurs de cannabis que les procureurs fédéraux pourraient consulter s’ils le souhaitaient et quand ils le souhaitaient. Ainsi, pendant toutes les années qui ont suivi, une vaste expérience de santé publique a été menée sans qu’aucune agence d’État n’en assure le suivi.
En 2006, dix ans après la légalisation de l’usage médical, Mikuriya a mené une enquête auprès de 30 médecins qui avaient participé aux réunions du California Cannabis Research Medical Group (qu’il avait organisé en 2000). Il a publié les résultats dans O’Shaughnessy‘s, une revue qu’il a cofondée avec l’un d’entre nous (Fred Gardner) en 2003.
Environ 160 000 patients avaient été autorisés à utiliser la plante par les médecins interrogés. À l’unanimité, les médecins ont été frappés par la mesure dans laquelle le cannabis permettait aux patients de réduire leur consommation de médicaments sur ordonnance et en vente libre. Comme le dit Mikuriya : « Les opioïdes, les sédatifs, les AINS et les antidépresseurs ISRS sont couramment utilisés en plus petites quantités ou abandonnés. Ce sont tous des médicaments qui ont des effets indésirables graves. »
Le Dr Robert Sullivan, l’un des premiers médecins à proposer des consultations sur le cannabis dans le comté d’Orange, en Californie, a rapporté que ses patients avaient réduit leur consommation « d’opiacés, de relaxants musculaires, d’antidépresseurs, d’hypnotiques (pour le sommeil), d’anxiolytiques, de neurontin, d’anti-inflammatoires, d’antimigraineux, de médicaments pour l’appareil digestif, de prednisone (pour l’asthme, l’arthrite). » Le cannabis s’est avéré être l’anti-drogue.
Les rapports sur les patients souffrant de douleurs qui consomment du cannabis et qui réduisent leur consommation d’opioïdes de 50 % concordent parfaitement avec les études montrant que les animaux de laboratoire ont besoin de deux fois moins d’opioïdes pour obtenir un soulagement de la douleur lorsqu’ils sont également traités avec un cannabinoïde. Faut-il s’étonner que les fabricants de médicaments de synthèse considèrent l’usage médical du cannabis comme une menace pour leurs marges bénéficiaires ?
Qu’en est-il des prétendus effets indésirables, dont la dépendance, sur lesquels repose la prohibition de la marijuana ? Le Dr Philip Denney a déclaré à propos de l’enquête menée sur dix ans : « Pratiquement aucun rapporté par les patients, à l’exception des contacts avec le système juridique. Les patients peuvent facilement arrêter de consommer du cannabis pour passer des tests de dépistage de drogues ou lorsqu’ils voyagent. Les surdoses dues au cannabis comestible – une somnolence désagréable qui dure six à huit heures – sont rares et passagères. »
Le Dr Frank Lucido a répondu qu’une « baisse de productivité » avait poussé deux patients à arrêter de consommer du cannabis. Mais, a-t-il ajouté, « l’écrasante majorité d’entre eux déclarent qu’ils sont plus productifs lorsque leurs symptômes sont contrôlés par le cannabis. » Les employeurs sont priés de prendre note.

Les fleurs de cannabis disponibles dans les dispensaires ont permis aux patients des États où la marijuana est utilisée à des fins médicales de réduire ou d’arrêter complètement l’utilisation de produits pharmaceutiques synthétiques qui ont des effets secondaires néfastes.
L’ère du CBD
L’adoption de la Proposition 215 en Californie a encouragé les gens du monde entier à faire pression pour obtenir l’accès au cannabis médicinal. En Angleterre, les patients atteints de sclérose en plaques (SEP) ont commencé à faire pression sur le ministère de la santé avec une urgence accrue. Au printemps 1997, les patients atteints de SEP ont organisé une réunion publique à Londres qui a attiré l’attention de l’entrepreneur pharmaceutique Geoffrey Guy, MD, qui s’est engagé à les aider à atteindre leur objectif.
Guy a observé que le cannabis utilisé en Angleterre par les patients atteints de sclérose en plaques et d’autres personnes faisant état de bienfaits médicaux contenait des quantités substantielles de CBD et de THC. La psychoactivité réduite du cannabis riche en CBD serait un argument de vente clé lorsqu’il présenterait au ministère de l’Intérieur son projet de production d’un médicament à base de cannabis de qualité pharmaceutique. Sa société, GW Pharmaceuticals, a reçu l’autorisation de cultiver du cannabis à cette fin au printemps 1998.
Pour obtenir l’autorisation de mise sur le marché, les extraits de GW devaient être produits avec une régularité quasi parfaite et démontrer leur innocuité et leur efficacité lors d’essais cliniques. La première étape de Guy a été d’acheter la collection de plantes génétiquement diverses de Hortapharm, une entreprise néerlandaise fondée dans les années 1980 par David Watson et Robert Clarke, deux ex-patriotes américains.
Ce sont eux qui ont eu l’intuition que le CBD et les composés autres que le THC avaient des effets significatifs. Ils ont parcouru le monde pour collecter des souches « land-race », dont certaines contenaient des quantités substantielles de ces cannabinoïdes « mineurs » jusqu’alors ignorés Watson et Clarke ont également compris que les terpénoïdes qui donnent aux variétés de cannabis leurs arômes exercent des effets lorsqu’ils sont ingérés.
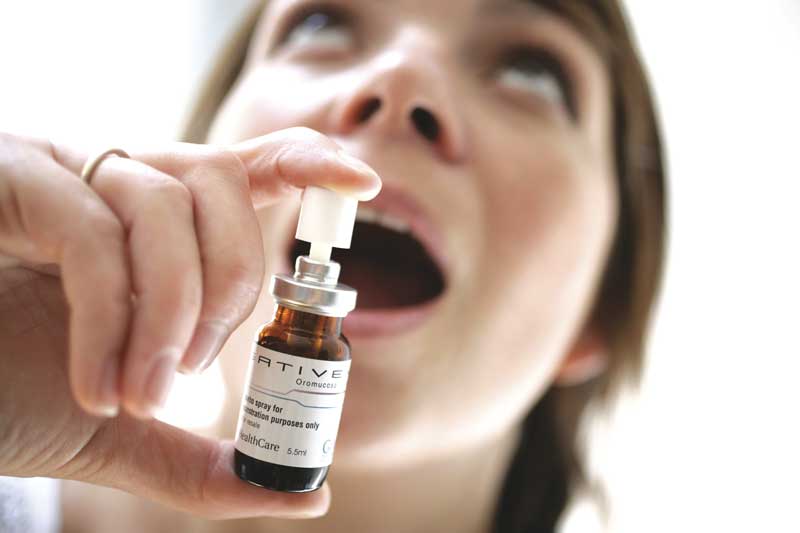
Le Sativex de GW Pharmaceuticals, un spray sub-lingual de cannabinoïdes, est composé de quantités à peu près égales de CBD et de THC.
GW a entrepris de cultiver des milliers de plantes dans des serres sophistiquées du sud-est de l’Angleterre. En plus de développer des souches à forte teneur en THC et en CBD, GW a cultivé des plantes riches en cannabichromène (CBC), en cannabigérol (CBG) et en tétrahydrocannabivarine (THCV) afin de tester leurs effets médicaux. Ces dernières années, la cannabidivarine (CBDV) est devenue un composé intéressant pour l’entreprise.
En 1999, GW produisait son médicament phare, le Sativex – un extrait de plante entière formulé pour être pulvérisé sous la langue. Le Sativex contient des quantités à peu près égales de CBD et de THC, ainsi que des traces de tous les autres composés produits par la plante. GW a lancé des essais cliniques et a commencé à fournir le Sativex et d’autres extraits de cannabis aux chercheurs. Leurs conclusions, rapportées dans des articles de journaux et lors de conférences dans les années qui ont suivi, suggèrent que le CBD pourrait soulager les symptômes de la polyarthrite rhumatoïde, du diabète, de l’épilepsie, de l’alcoolisme, du SSPT, des infections résistantes aux antibiotiques et des troubles neurologiques. Le CBD a également démontré des effets neuroprotecteurs et anticancéreux. Les personnes utilisant Sativex ont diminué leur consommation d’opiacés et d’autres médicaments pharmaceutiques. Sativex produit moins d’effets secondaires, et des effets plus légers, que le THC pur (Marinol).
En avril 2005, le Sativex a reçu l’approbation conditionnelle de Santé Canada comme traitement de la douleur dans la sclérose en plaques. Le Royaume-Uni et une vingtaine d’autres pays ont approuvé le Sativex pour le traitement de la spasticité dans la sclérose en plaques. Le Sativex fait actuellement l’objet d’essais cliniques en tant que traitement de la douleur cancéreuse aux États-Unis et dans d’autres pays.
Pendant de nombreuses années, on a supposé que le CBD avait été réduit à l’état de traces dans tout le cannabis cultivé aux États-Unis à des fins médicales et récréatives. Comme aucun laboratoire de chimie analytique ne testait les échantillons de cannabis, il n’y avait aucun moyen d’évaluer la teneur en cannabinoïdes. Cette situation a changé au cours de l’hiver 2008-2009 lorsque Steve DeAngelo, directeur du Harborside Health Center d’Oakland, a encouragé deux anciens cultivateurs, David Lampach et Addison DeMoura, à lancer un laboratoire, judicieusement baptisé Steep Hill.
Harborside a fourni au laboratoire un flux régulier d’échantillons pour tester la présence de moisissures et analyser les niveaux de THC, de CBD et de CBN.
Il s’est avéré que le cannabis riche en CBD n’était pas aussi rare en Californie que les experts l’avaient prédit. O’Shaughnessy ‘s a rapporté qu’environ un échantillon sur 600 apporté à Steep Hill et à d’autres laboratoires en 2009 contenait 4 % ou plus de CBD. ProjectCBD a été créé pour rendre compte de ce que les médecins, les patients, les cultivateurs et les fabricants apprennent sur les médicaments riches en CBD.
P.S. (Post Sanjay)
En août 2013, Sanjay Gupta, médecin, a été le narrateur d’un documentaire sur CNN dans lequel il a reconnu que nous avions tous été « systématiquement mal éduqués » au sujet de la marijuana. L’émission présentait des exemples spectaculaires de cannabis exerçant des effets bénéfiques. L’histoire la plus mémorable est celle d’une petite fille de cinq ans, Charlotte Figi, atteinte d’une forme grave d’épilepsie.
Les crises de Charlotte s’étaient intensifiées à mesure que les traitements conventionnels échouaient. Sa mère, à Colorado Springs, et son père, un sergent des forces spéciales déployé en Afghanistan, ont fait des recherches en ligne et ont appris que le cannabis était un anticonvulsivant. Paige Figi s’est procuré des bourgeons dans des dispensaires et un ami lui a appris à extraire de l’huile pour Charlotte. Une variété riche en CBD a permis de soulager les crises, mais Paige n’a pas pu se réapprovisionner.

Wernard Bruining a fondé le premier café d’Amsterdam, Mellow Yellow, en 1972. Aujourd’hui, il est l’avant-garde néerlandaise en matière de cannabis médical. Visite son site, www.mediwiet.nl pour plus d’informations.
Photo par Lika Bruining.

Les docteurs Sanjay Gupta et Geoffrey Guy dans les installations de culture de GW Pharmaceuticals. GW cherche à obtenir l’approbation de la FDA pour le Sativex (pour traiter les douleurs cancéreuses rebelles) et l’Epidiolex (pour les épilepsies pédiatriques).
En février 2012, elle a rencontré Joel Stanley qui, avec ses frères, cultivait de la marijuana pour leurs propres dispensaires et avait une souche de chanvre qui fonctionnait miraculeusement bien pour Charlotte. Les Stanley ont rebaptisé leur plante « Charlotte’s Web » et ont proposé de la cultiver en grande quantité pour les Figis et d’autres personnes dans le besoin. Lorsque Sanjay Gupta a visité leur serre, l’un des frères Stanley a pointé du doigt un plant de Charlotte’s Web et a déclaré : « Il n’y a rien de tel dans le monde. Cette plante contient 21 % de CBD et moins de 1 % de THC. »
Heureusement, il existe d’autres plantes de cannabis dont le rapport CBD:THC est supérieur à 20:1, et elles sont cultivées en Californie et dans d’autres États où cela est légal. Il n’est pas non plus évident que plus le rapport CBD:THC est élevé, plus le médicament est efficace. Il existe peut-être un ratio optimal pour traiter chaque maladie et chaque individu. La teneur en terpénoïdes et en flavonoïdes influencera les effets de tout médicament à base de cannabis. Une opportunité de recherche stimulante se présente aux médecins et aux patients, aux cultivateurs et aux fabricants de médicaments.
Le Farm Bill fédéral de 2014 a légalisé la culture du « chanvre industriel « contenant 0,3 pour cent de THC ou moins à des fins de recherche. Cela a permis aux frères Stanley de cultiver 36 000 plants de Charlotte’s Web – maintenant sélectionnés pour contenir 30:1 de CBD-to-THC – sur 17 acres, et de redéfinir leur extrait en tant qu’huile de chanvre CW. Plusieurs milliers de plants de chanvre ont également été cultivés dans le Kentucky à des fins médicales. le « chanvre industriel » fournit plus que de la nourriture et des fibres. Un projet de loi visant à retirer le CBD et le chanvre de la loi sur les substances contrôlées a été présenté au Congrès.
Des centaines de parents d’enfants atteints d’épilepsie, de cancer et d’autres maladies graves ont déménagé au Colorado dans l’espoir d’obtenir le Charlotte’s Web. Une association à but non lucratif appelée Realm of Caring, cofondée par Paige Figi, conseille les familles qui utilisent le produit des frères Stanley, tient une liste d’attente de clients potentiels et fait office de ressource éducative. En 2014, onze États ont adopté des projets de loi légalisant le cannabis contenant d’infimes quantités de THC. Les prohibitionnistes considèrent que ces projets de loi dits de CBD uniquement siphonnent le soutien des projets de loi qui légaliseraient le THC à des fins médicales (comme cela s’est produit en Floride en novembre 2014). Les défenseurs les considèrent comme un premier pas vers une législation plus complète.
De nombreuses entreprises produisent et distribuent des médicaments à base de cannabis aux États-Unis et à l’étranger. Les plus audacieuses vendent des produits riches en CBD par courrier et en ligne. Bien que le CBD reste inscrit à l’annexe 1 de la loi fédérale sur les substances contrôlées, les produits alimentaires à base de chanvre contenant moins de 0,3 pour cent de THC sont légaux (et en vente chez Costco).

Lawrence Ringo (à gauche) et Jaime Carion (obtenteur de ‘Cannatonic’, Resin Seeds) à la High Times Medical Cannabis Cup à San Francisco. Personne n’a fait plus que ces deux hommes pour accélérer et élargir la disponibilité des plantes riches en CBD à usage médical.
Les régulateurs fédéraux n’ont pas pris de mesures contre les entreprises qui importent des produits médicaux contenant de plus grandes quantités de CBD extraites de plantes de chanvre cultivées légalement à l’étranger. Les frères Stanley – à qui l’on a déconseillé en 2014 d’expédier l’huile de chanvre Charlotte’s Web du Colorado à des patients d’autres États – prévoient maintenant de cultiver des plantes en Uruguay et dans d’autres pays étrangers, et de renvoyer l’huile à des patients aux États-Unis.
GW Pharmaceuticals cherche à obtenir l’approbation de la FDA pour Epidiolex, un extrait de CBD dépourvu de THC. Epidiolex a été mis à la disposition en 2014 des spécialistes de l’épilepsie menant des programmes de recherche de nouveaux médicaments (IND) dans des hôpitaux aux États-Unis, impliquant quelque 200 enfants. Plus de la moitié d’entre eux ont connu des crises nettement moins nombreuses et moins graves. Environ 15 % n’ont pas été aidés, et environ 15 % n’ont pas eu de crises. Un schéma similaire a été rapporté par Bonni Goldstein, MD, et Margaret Gedde, MD, des médecins qui traitent des centaines d’enfants en utilisant du cannabis riche en CBD pour l’épilepsie à Los Angeles et à Colorado Springs, respectivement.
Martin Lee, organisateur du projet CBD, déclare : « Quelle ironie que la prohibition du cannabis, présentée au Congrès et à un public crédule comme un moyen de protéger les enfants d’un vice mortel, s’effondre parce que les enfants ont un besoin urgent de cannabis comme médicament. »
Le groupe de médecins organisé par Tod Mikuriya en 2000, aujourd’hui connu sous le nom de Society of Cannabis Clinicians, comptait plus de 100 membres en juin 2014. La SCC est dirigée depuis 2009 par Jeffrey Hergenrather, docteur en médecine, l’un de ses membres fondateurs. « La compréhension des médecins et des patients sur le fonctionnement du cannabis a considérablement progressé ces dernières années », explique-t-il. « Il est maintenant temps que les écoles de médecine reconnaissent le système endocannabinoïde »
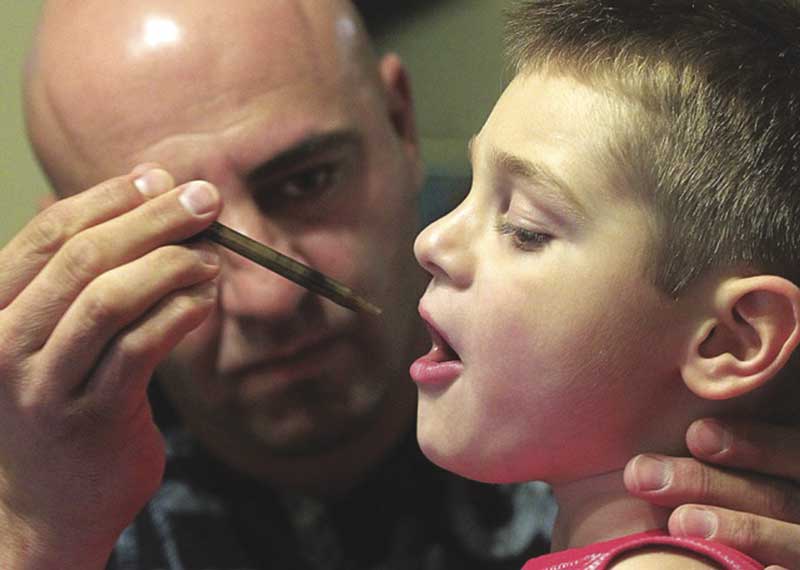
Jason David a administré de l’aceite rico en CBD du Harborside Health Center d’Oakland à son fils Jayden, ce qui a permis d’atténuer les convulsions. La nouvelle de l’amélioration de Jayden a inspiré les parents de Charlotte Figi à rechercher du CBD au Colorado. Photo de Braverman Productions.
Liens intéressants
O’Shaughnessy‘s, couvre l’histoire du mouvement en faveur de la marijuana médicale.
ProjectCBD.org fait le point sur la disponibilité du CBD et sur ce que les scientifiques, les médecins, les patients et les cultivateurs apprennent à son sujet.
The CBD Crew, un partenariat entre Mr. Nice et Resin Seeds, produit des variétés riches en CBD.

